如何让纳米药物更高效地进入肿瘤细胞,是实现精准治疗的关键一环。近日,厦门大学附属第一医院超声科张晓东主任与厦门大学药学院霍帅东团队在超声控制药物递送领域取得最新进展,首次系统揭示了纳米载体颗粒尺寸在超声增强肿瘤细胞内吞过程中的决定性作用,为开发超声智能响应型纳米药物提供了重要的理论指导。相关成果研究成果以“Size-dependent ultrasound enhancement of nanoparticle endocytosis in tumor cells”为题发表于领域权威期刊 《Ultrasonics Sonochemistry》(中科院一区Top,IF=9.7)。
纳米药物的疗效高度依赖于其被肿瘤细胞内吞的效率。尽管超声介导的“声孔效应”已被广泛用于增强药物递送,但超声与纳米颗粒内吞之间的精细相互作用机制,尤其是尺寸如何影响这一过程,一直是该领域待解的谜题。针对这一关键科学问题,该团队在前期系统性工作(Nature Chemistry,2021,13,131;Angewandte Chemie,2021,60,14707;Advanced Science, 2022, 9, 2104696等)的基础上,将研究视角从分子与纳米尺度的药物激活延伸至细胞水平的药物递送过程。他们设计并合成了一系列尺寸在20至100 nm之间的二氧化硅纳米颗粒作为纳米药物模型,系统探究了其在超声作用下的内吞规律。
实验结果显示:超声能显著增强20至80 nm尺寸范围内纳米颗粒的细胞内吞效率,且效果呈现出强烈的尺寸依赖性。其中,40 nm的颗粒在超声作用下内吞效率提升了3.8倍,表现出最优的超声响应性能。进一步的机制研究证明了超声的双重作用:不仅可以通过“声孔效应”为纳米颗粒打开非能量依赖性的“快速通道”;更重要的是能够“解锁”并激活细胞自身的多种内吞途径,甚至逆转小窝蛋白、网格蛋白等多种内吞抑制剂的“封锁”作用,从而大幅提升纳米颗粒的入胞效率。该研究首次系统阐明了纳米颗粒尺寸在超声增强内吞过程中的核心地位,并揭示了超声通过激活多种内吞途径协同“声孔效应”促进药物入胞的双重机制。相关发现为设计具有尺寸可控与超声响应性能的下一代药物递送系统提供了数据支撑和理论指导。
张晓东主任医师与霍帅东教授为该论文的共同通讯作者,药学院博士研究生廖志环、硕士文梓豪为论文的共同第一作者。厦门大学附属第一医院超声影像科、厦门大学药学院、福建省药物新靶点研究重点实验室为该论文的第一完成单位。该研究获得了国家自然科学基金、福建省自然科学基金、深圳市自然科学基金及厦门大学南强青年拔尖人才计划等多项研究资金的支持。
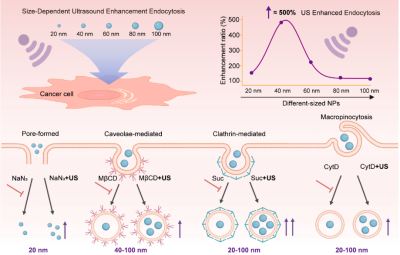
超声增强纳米药物递送新机制研究示意图
文章链接:
https://doi.org/10.1016/j.ultsonch.2025.107580